新冠小鼠模型-抗疫助
冠狀病毒容易出現新的宿主物種,最近由SARS-CoV-2(COVID-19大流行的病原體)證明。迫切需要概括SARS-CoV-2疾病的小動物模型來快速評估醫療對策(MCM)。SARS-CoV-2不能感染野生型實驗室小鼠,因為病毒尖峰(S)蛋白與人類受體ACE2的小鼠同源物之間的相互作用效率低下。我們使用反向遺傳學來重塑S和mACE2結合界面,從而產生一種重組病毒(SARS-CoV-2 MA),該病毒可以利用mACE2進入。SARS-CoV-2 MA在年輕成人和老年BALB / c小鼠的上呼吸道和下氣道中復制。重要的是,老年小鼠的疾病更嚴重,并且比hACE2轉基因小鼠的表型顯示出更多的臨床相關表型。然后,我們通過在具有mACE2天然表達的免疫能力小鼠中的疫苗激發試驗研究證明了該模型的實用性。最后,我們表明臨床候選干擾素(IFN)lambda-1a可以在
體外有效抑制原代人氣道上皮細胞中的SARS-CoV-2復制,并且預防性和治療性給藥都會減少小鼠的復制。我們的小鼠適應SARS-CoV-2模型展示了與年齡相關的疾病發病機制,并支持IFN lambda-1a治療在人類COVID-19感染中的臨床應用。
首批結果已經出來了:據NATURE雜志3月12日報導,中國醫學科學院醫學實驗動物研究所建立了轉基因小鼠模型和恒河猴新冠肺炎(COVID-19)的疾病模型,報告了感染含有人ACE2基因的猴子和小鼠的初步發現。人源ACE2也是新冠病毒(SARS-CoV-2)借以進入細胞的蛋白。此項工作豐富了對COVID-19病因學和病理學的認識,為進一步研究感染與發病機制、傳播途徑、藥物和疫苗評價等提供了不可缺少的關鍵支撐。
澳大利亞動物健康實驗室的病毒學家們發現,雪貂對新冠病毒SARS-CoV-2易感。目前,研究人員正在研究傳染途徑,以便之后對潛在疫苗進行測試。雪貂是流感和其他呼吸道疾病的常用動物模型,因為它們的肺部生理與人類相似。但是,沒有哪一種動物模型是完美的。我們需要的往往不是一種動物模型,而是多種動物模型。猴子和小鼠可以揭示不同的感染信息,有助于闡明免疫系統的作用或是病毒的傳播方式。
SARS研究中的小鼠模型回顧
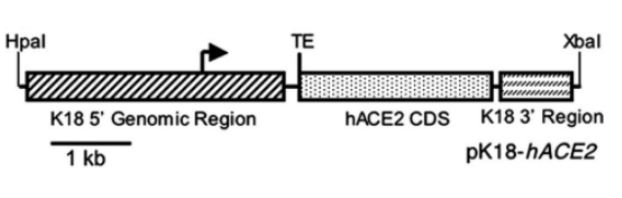
歷史總是驚人的相似,從SARS到MERS,所用到的動物模型對我們現在選擇新冠病毒動物模型都有著重要的借鑒意義。2016年美國國立衛生研究院傳染病實驗室Troy C Sutton和Kanta Subbarao教授發表綜述性文章,詳細論述了在研究冠狀病毒的過程中動物模型的發展和應用。從小鼠模型來看,研究者用BALB/c近交系小鼠從鼻腔滴入SARS-CoV進行攻毒實驗,但是結果發現,小鼠沒有出現體重減輕、肺部病理等臨床現象。用C57BL/6小鼠獲得了相似的結果,仍然缺乏臨床表型。在B6以及129SvEv背景條件下,缺乏NK細胞功能或者NK-T細胞的CD1-/-小鼠,和缺乏T和B淋巴細胞的RAG1-/-小鼠的病毒復制動力學相似,且均未出現臨床疾病表型。B6背景的STAT1-/-小鼠在組織病理學檢查中顯示有自限性毛細支氣管炎和片狀間質性肺炎。但是,在129SvEv背景的STAT1-/-小鼠中,表現出進行性體重減輕和細支氣管炎,并發展為間質性肺炎和縱隔炎。盡管小鼠顯示出感染和肺部疾病的跡象,但近交系小鼠未能準確地再現在人類觀察到的彌漫性肺泡損傷、水腫、肺細胞壞死和透明膜形成。
為了模擬流行病學發現的高齡所導致的死亡率增加現象,研究者開發了SARS-CoV的老年小鼠模型。在此模型中,BALB/c和B6小鼠在肺中表現出高水平的病毒復制,并且這兩種小鼠的體重均有減輕,成年BALB/c小鼠還表現出皮毛褶皺和脫水。所有試驗觀察到,老年小鼠模型對病毒的反應更接近人類所表現出的病毒感染表型,因此老年小鼠比年輕小鼠得到了更廣泛的應用。
新型小鼠模型制備新冠小鼠模型除了轉基因的方式之外,還有用腺病毒載體轉導hACE2制備新冠模型小鼠的方法。2020年6月10日,廣州呼吸疾病國家重點實驗室趙金存教授團隊聯合多家單位共同發表了利用腺病毒載體制備的新冠小鼠模型,如下圖所示,該研究通過復制缺陷型腺病毒(Ad5-hACE2)將外源hACE2通過鼻內轉導的方式遞送入C57BL/6和BALB/c兩種品系及相應基因敲除的小鼠中,對小鼠進行攻毒實驗,通過免疫印跡和流式細胞術檢測hACE2的表達。
研究觀察到hACE2主要在肺泡上皮中表達,偶爾在氣道上皮中有陽性細胞。感染新冠病毒的Ad5-hACE2轉導的BALB/c小鼠以及C57BL/6在感染2天后開始出現皮毛起皺、駝背和呼吸困難等癥狀,類似于SARS-CoV感染BALB/c小鼠。兩種小鼠品系的肺組織均顯示出多種損傷,包括血管周圍至間質性炎性細胞浸潤、壞死細胞碎片和肺泡水腫。這些都表明,該方法制備的新冠小鼠模型對新冠病毒易感,能夠有效評估疫苗和藥物的療效。